2021年,恒瑞医药海外研发投入共计12.36亿元,占总体研发投入的比重达到19.93%。2021年中报,恒瑞首次披露公司海外临床研发团队情况:现有规模136人,其中美国95人,欧洲31人;2021年年报显示,恒瑞海外研发团队共计170余人,其中美国团队104人,欧洲团队50人。海外团队主要成员均是来自罗氏、诺华、辉瑞以及默克等知名药企的中高层人才,拥有丰富的全球化研发经验。
疯狂投入下,恒瑞终于迎来了里程碑式的节点。
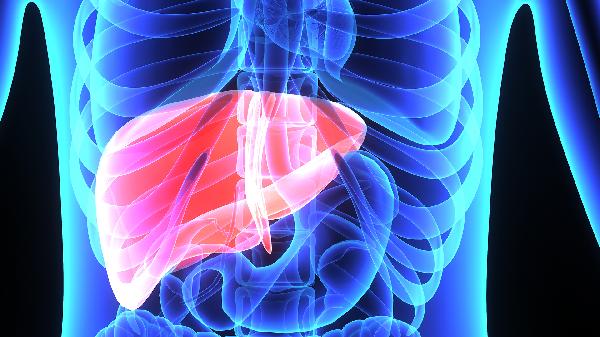
2022年5月12日,恒瑞医药发布公告,公司的注射用卡瑞利珠单抗(PD-1)联合阿帕替尼片的国际多中心三期临床试验由独立数据监察委员会判定,主要研究终点结果达到方案预设的优效标准。
国际多中心临床,受试者多样化。这项三期临床SHR-1210-III-310是一项评估卡瑞利珠单抗联合阿帕替尼对比索拉非尼治疗既往未接受过系统治疗的不可切除或转移性肝细胞癌患者有效性和安全性的随机对照、开放性、国际多中心三期临床研究,
由全球13个国家和地区的95家中心共同参与,该研究是公司开展的首个国际多中心三期临床研究。
研究结果表明,卡瑞利珠单抗联合阿帕替尼对比索拉非尼,作为一线治疗方案,可以显著延长晚期肝细胞癌患者的无进展生存期(PFS)以及总生存期(OS)。
目前,恒瑞医药已完成与美国FDA的多轮沟通,计划近期向FDA递交新药上市的沟通交流申请。目前,国内的上市申请已获得中国药监局受理。
这意味着,恒瑞的PD-1出海在即了吗?
但事实上,临床成功不意味着获批,FDA这一关并不好过,有5个问题需要解释。
1、需要解释两种药物联合治疗的理由:
由于恒瑞医药卡瑞利珠单抗并没有在美国开展1期临床试验,没有人种安全性数据。再由于恒瑞医药卡瑞利珠单抗(PD-1),阿帕替尼两种创新药都没有在美国获批上市。恒瑞医药需要解释一下,两种药物联合用药的原因。
理论上,恒瑞医药需要设计一项三臂试验,卡瑞利珠单抗+阿帕替尼vs卡瑞利珠单抗vs索拉非尼。阿斯利康的PD-L1联合CTLA-4,一线治疗肝细胞癌,国际多中心3期临床可是开展了三臂试验。
2、肝细胞癌是真正的孤儿病吗?需要解释美国入组患者比例太少的理由:
美国每年新增肝癌4.6万例,每年新增鼻咽癌0.2万例。肝细胞癌患者数量远远大于鼻咽癌(君实申报的适应症)。恒瑞医药仅仅在3期临床入组了24%比例的海外患者,海外入组患者中还包括了中国香港、中国台湾。
人种差异,是FDA最新强调的重点。
虽然,72%的肝细胞癌新增病例发生在亚洲,但是,日本、欧洲、美国的肝细胞癌患者基线状态是——丙肝患者比例大于50%。
中国肝细胞癌患者基线状态是——大多数都是乙肝患者。
乙肝导致的肝细胞癌,与丙肝导致的肝细胞癌,可能是两种疾病。即使是中国TW、曰本、新加坡的丙肝合并肝细胞癌患者比例,也远远超出中国大陆。
3、需要解释不是双盲对照试验的理由
●罗氏T药(PD-L1)+贝伐珠单抗一线治疗肝细胞癌,的确是开放标签,不是双盲对照试验。
罗氏的理由很简单,是FDA批准的突破性疗法认定。并且,贝伐珠单抗是乳白色注射液,无法开展双盲。
●默沙东K药(PD-1)+仑伐替尼一线治疗肝细胞癌,可是货真价实的双盲对照试验,今年7月数据读出(即将揭盲)。也是#突破性疗法认定#,审评时间是6个月。
●恒瑞医药的审评时间是10个月。
恒瑞医药呢?开展卡瑞利珠单抗的双盲对照试验,难度并不大,怎么解释?
4、肝细胞癌一线治疗美国上市申请注册数量多,FDA应接不暇
由于晚期肝细胞癌一线治疗不是未满足的医疗需求,FDA一定会严格控制上市标准。
PD-1监管灵活性,大概率只适用于——未满足的医疗需求。
5、美国目前的晚期肝细胞癌一线,首选标准治疗方案不是索拉非尼,恒瑞医药需要做出解释选择对照组的合理性
恒瑞医药卡瑞利珠单抗对照组为索拉非尼(2007年FDA批准上市),默沙东K药对照组为仑伐替尼(2018年FDA批准上市)。恒瑞医药选择了相对较弱的对照组,理论上注册临床试验研究更易成功。
更多健康资讯请点击医药头条,为您带来更多精彩内容!